Propriétés de l’Or dans le tableau périodique
Structure atomique de l'or
L’atome d’or est défini par un numéro atomique de 79, ce qui signifie qu’il possède 79 protons dans son noyau. Sa configuration électronique est [Xe] 4f14 5d10 6s1. Cette structure indique que l’or a un électron unique dans sa couche externe, ce qui joue un rôle central dans ses propriétés chimiques et physiques.
L’or appartient au groupe 11 du tableau périodique, aux côtés de l’argent (Ag) et du cuivre (Cu). Ces éléments sont parfois appelés métaux de transition précieux en raison de leurs propriétés communes, notamment leur conductivité électrique et leur résistance à la corrosion. La masse atomique de l’or est d’environ 196,97 u, et son rayon atomique est d’environ 144 picomètres.
Propriétés physiques de l'or
L’or est caractérisé par sa couleur jaune métallique distincte. Ce métal possède une densité élevée, mesurant environ 19,32 g/cm³, ce qui en fait l’un des métaux les plus denses. Son point de fusion est de 1064,18 °C et son point d’ébullition est de 2856 °C, des valeurs qui témoignent de la robustesse des liaisons métalliques dans son réseau cristallin.
En raison de sa malléabilité et de sa ductilité exceptionnelles, l’or peut être façonné en feuilles extrêmement fines, appelées feuilles d’or, d’une épaisseur de quelques nanomètres. Cette propriété est utilisée dans des domaines tels que l’art, la décoration et même la fabrication de dispositifs électroniques sensibles.
Propriétés chimiques de l'or
Réactivité chimique
L’or est réputé pour sa résistance remarquable à la corrosion et à l’oxydation, même dans des environnements agressifs. Contrairement à de nombreux métaux, il ne réagit pas avec l’oxygène ou la plupart des acides. Cette inertie chimique est attribuée à la structure compacte de ses électrons de valence et à sa configuration électronique stable.
Malgré son inertie, l’or peut réagir avec des agents chimiques spécifiques, comme l’eau régale, un mélange d’acide nitrique et d’acide chlorhydrique concentrés. Cette réaction permet de dissoudre l’or, formant des complexes comme l’acide chloraurique (HAuCl4).
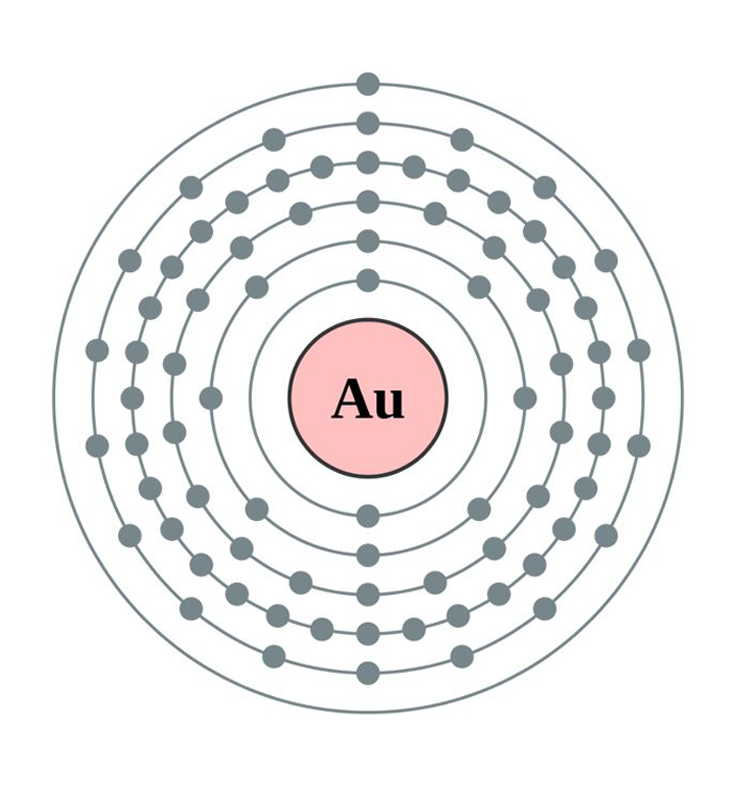
Comportement dans les alliages
L’or est souvent combiné avec d’autres métaux pour former des alliages. Ces mélanges modifient ses propriétés physiques, notamment sa dureté et sa couleur. Par exemple, l’ajout d’argent ou de palladium peut donner de l’or blanc, tandis que le cuivre produit de l’or rose. Ces alliages sont couramment utilisés en joaillerie et dans les applications industrielles.
Applications technologiques de l'or
En raison de sa conductivité électrique exceptionnelle, l’or est utilisé dans l’industrie électronique, notamment pour les connecteurs, les contacts et les circuits imprimés. Son inertie chimique garantit qu’il ne se corrode pas, même dans des conditions environnementales difficiles, ce qui en fait un choix idéal pour les composants critiques.
L’or joue également un rôle important en médecine. Les nanoparticules d’or sont utilisées dans des traitements expérimentaux pour lutter contre le cancer, grâce à leur capacité à cibler et à chauffer les cellules tumorales de manière précise. Dans le domaine de la recherche, il est utilisé comme catalyseur dans des réactions chimiques complexes.
Propriétés de l'or dans le tableau périodique
L’or se distingue dans le tableau périodique par son appartenance au bloc d. En tant que métal de transition, il possède des orbitales partiellement remplies, ce qui contribue à ses propriétés uniques. Il partage des similitudes avec l’argent et le cuivre, mais sa stabilité chimique supérieure et sa couleur caractéristique le rendent exceptionnel.
Son abondance relative dans la croûte terrestre est faible, environ 0,004 ppm. Il est généralement trouvé sous forme native, souvent associé à des minéraux comme la pyrite ou le quartz. Les gisements d’or sont exploités dans des régions comme l’Afrique du Sud, l’Australie et le Canada.