Qu’est-ce que l’électronégativité dans le tableau périodique ?
Définition et principes fondamentaux de l’électronégativité
L’électronégativité désigne la tendance d’un atome à attirer les électrons d’une liaison covalente. Cette propriété dépend du nombre de protons dans le noyau (charge nucléaire) et de la distance entre le noyau et les électrons de valence. Elle a été introduite par Linus Pauling, qui a établi une échelle relative d’électronégativité, connue sous le nom d’échelle de Pauling. Sur cette échelle, l’élément le plus électronégatif est le fluor, avec une valeur de 3,98, tandis que les métaux alcalins tels que le césium et le francium possèdent des valeurs faibles, proches de 0,7.
Facteurs influençant l’électronégativité
Plusieurs facteurs influencent l’électronégativité d’un élément. La taille atomique joue un rôle déterminant : plus un atome est petit, plus ses électrons de valence se trouvent proches du noyau, ce qui augmente son électronégativité. La charge nucléaire effective, qui représente la force d’attraction entre le noyau et les électrons de valence après prise en compte des effets d’écran des électrons internes, influence également cette propriété. Enfin, la configuration électronique d’un atome peut accentuer ou limiter sa capacité à attirer des électrons.
Classement des éléments chimiques par électronégativité
Dans le tableau périodique, l’électronégativité suit des tendances spécifiques selon les groupes et les périodes. Ces variations permettent de classer les éléments selon leur propension à attirer les électrons.
Variations dans les périodes
En progressant de gauche à droite dans une période, l’électronégativité augmente. Cela s’explique par une augmentation du nombre de protons dans le noyau, ce qui renforce l’attraction exercée sur les électrons de liaison. Par exemple, le sodium (Na), situé à l’extrémité gauche d’une période, présente une électronégativité de 0,93, tandis que le chlore (Cl), à l’extrémité droite, affiche une valeur de 3,16.
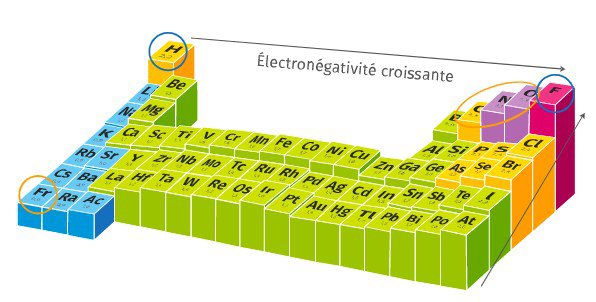
Variations dans les groupes
Dans un groupe, l’électronégativité diminue de haut en bas. La taille atomique croît avec l’ajout de nouvelles couches électroniques, ce qui éloigne les électrons de valence du noyau et réduit leur attraction. Par exemple, dans le groupe des halogènes, le fluor (F) possède une électronégativité élevée de 3,98, alors que l’iode (I) est moins électronégatif avec une valeur de 2,66.
Les éléments les plus et les moins électronégatifs
Le fluor est souvent utilisé comme référence pour illustrer une forte électronégativité. Il interagit avec une grande variété d’éléments pour former des composés stables, comme dans le fluorure de sodium (NaF) ou le tétrafluorure de carbone (CF4). À l’opposé, le francium et le césium, avec leurs faibles électronégativités, participent principalement à des réactions où ils cèdent facilement leurs électrons, comme dans le cas du chlorure de césium (CsCl).
Applications pratiques de l’électronégativité
L’électronégativité joue un rôle central dans la chimie descriptive, la chimie organique et les sciences des matériaux. Elle aide à déterminer le type de liaison formée entre les atomes : liaison ionique, covalente ou métallique. Une différence importante d’électronégativité entre deux éléments, comme dans le cas du sodium (Na) et du chlore (Cl), conduit à une liaison ionique, où l’électron est transféré de l’un à l’autre. Une faible différence d’électronégativité, comme entre le carbone (C) et l’hydrogène (H), favorise des liaisons covalentes non polaires.
En chimie industrielle, l’électronégativité aide à prédire les interactions des molécules dans des processus tels que la catalyse. Par exemple, les catalyseurs à base de platine ou de palladium tirent parti de leur électronégativité pour améliorer la réactivité des substrats. Dans les sciences biologiques, elle permet de comprendre les interactions moléculaires fondamentales, comme la polarité des liaisons dans l’eau (H2O), essentielle à la vie.